- ECOGRAFIA DEL I TRIMESTRE DI GRAVIDANZA
- ECOGRAFIA DEL II TRIMESTRE DI GRAVIDANZA
- ECOGRAFIA DEL III TRIMESTRE DI GRAVIDANZA
- ECOGRAFIA TRIDIMENSIONALE
- SCREENING ECOGRAFICO DEL RISCHIO DI CROMOSOMOPATIA
- SCREENING ECOFLUSSIMETRICO PER IL RISCHIO DI GESTOSI
- ECOFLUSSIMETRIA FETALE
- ECOCARDIOGRAFIA FETALE
L’ecografia del l trimestre fornisce informazioni molto importanti ai fini del regolare decorso della gravidanza:
- consente di accertare la regolare sede intrauterina della gravidanza
- consente di stabilire il numero di camere gestazionali e di embrioni presenti
- permette la datazione dell’epoca di gestazione mediante la misurazione della lunghezza vertice-sacro dell’embrione (CRL)
- valuta il rischio statistico di aborto attraverso un particolare rapporto tra la biometria della camera gestazionale e quella dell’embrione
- consente di eseguire lo screening ecografico del rischio di cromosomopatia mediante valutazione della translucenza nucale (vedi: SCREENING ECOGRAFICO DI CROMOSOMOPATIA)
- può evidenziare la presenza di malformazioni uterine, fibromi e patologie degli annessi
L’esame ecografico viene eseguito in accordo con le Linee Guida della Società Italiana Ecografia Ostetrica e Ginecologica (SIEOG). Le anomalie congenite fetali hanno un’incidenza di circa il 5%, includendo:
- le malformazioni
- le malattie da aberrazioni cromosomiche (cromosomopatie)
- le malattie metaboliche
- le malattie da infezione materna
Lo screening ultrasonografico delle malformazioni fetali ed il loro riconoscimento consente di ridurre l’handicap infantile e la mortalità perinatale poiché le malformazioni fetali sono responsabili del 25% di tutte le morti perinatali. L’ecografia prenatale può riconoscere o escludere un discreto numero di patologie fetali gravi. Le ecografie da praticare nel corso della gravidanza fisiologica, come consigliato dal nostro SSN e da accreditate società scientifiche come la SIEOG (Società Italiana di Ecografia Ostetrica e Ginecologia) sono tre:
- 1) nel corso del I trimestre di gravidanza (fino a 13 settimane di gestazione)
- 2) nel II trimestre (preferibilmente tra la 19a e la 21a settimana di gestazione)
- 3) nel III trimestre (tra la 30a e la 34a settimana di gestazione)
Nel primo trimestre avanzato solo poche patologie malformative maggiori (ad esempio il mancato sviluppo della volta cranica – anencefalia – ed il mancato sviluppo di un arto – amelìa) possono essere riconosciute. La sensibilità (ovvero la capacità) dell’ecografia prenatale nel riconoscere le anomalie fetali è più elevata nel II trimestre, con una media del 48%. I dati della letteratura medica riportano un’accuratezza diagnostica minima del 30,3% in alcuni centri ed un’accuratezza diagnostica massima del 61,4% in altri centri. Lo studio ecografico prenatale dell’anatomia fetale è fortemente condizionato da diversi fattori che possono falsare i risultati, nonostante la correttezza dell’esame. Tali fattori possono essere cosi indicati:
- la variabilità della morfogenesi fetale (cioè dei tempi di sviluppo del corpo fetale) che non sempre consente deduzioni definitive con un unico esame ecografico
- lo spessore della parete addominale materna
- la posizione sfavorevole del feto
- le anomalie di quantità del liquido amniotico
- la gemellarità
- l’epoca di gestazione
Oltre al condizionamento dei risultati indotto dai fattori già indicati, va tenuto conto che non tutti gli organi e distretti corporei fetali possono essere visualizzati ecograficamente anche in relazione ai tempi diversi del loro sviluppo ed alle loro dimensioni.
Ad esempio, per le sue dimensioni il cuore fetale può essere esaminato dalla 20a settimana in poi, anche se lo studio cardiaco è molto meno agevole dopo la 30a settimana.
Intorno alla 20a settimana di gestazione, lo studio del cuore fetale con la scansione “4 camere” permette di individuare circa il 40% delle cardiopatie congenite. Alcune di queste (piccoli difetti settali, anomalie del ritorno venoso polmonare, coartazione aortica, etc.) non sono ecograficamente diagnosticabili.
Lo studio delle malformazioni del sistema nervoso centrale ha una sensibilità che va dal 68% al 92%. Il riconoscimento ecografico prenatale dei difetti del tubo neurale (spina bifida) presenta nel complesso (II e III trimestre) un’elevata sensibilità, che scende a valori più bassi con riferimento al solo II trimestre (circa 60%).
L’esame ecografico per la valutazione delle anomalie dell’apparato urinario presenta una sensibilità compresa tra il 24% ed il 90%: la notevole differenza statistica è legata alla difficoltà di riconoscere alcune malformazioni (ad esempio, mentre è facile riconoscere un rene multicistico a cisti multiple, è difficile riconoscere un rene multicistico caratterizzato nella sola iperecogenicità del suo parenchima).
Nel II trimestre possono esserci difficoltà anche nell’identificazione di entrambi i reni normali. Lo studio ecografico dell’addome fetale, la cui sensibilità è compresa tra il 24% ed il 72%, può consentire l’individuazione di difetti di chiusura della parete addominale (ernie), se il contenuto erniato è di notevole entità, ed ostruzioni intestinali. L’ostruzione intestinale non può essere osservata ecograficamente prima del III trimestre; le anomalie ostruttive del colon ed anorettali quasi mai sono identificabili in utero.
L’atresia esofagea è diagnosticabile solo nel 20 % dei casi (principalmente l’atresia esofagea senza fistola tracheo-esofagea). La diagnosi di ernia diaframmatica è possibile in circa il 50 % dei casi. L’epoca migliore per la visualizzazione degli arti fetali è compresa tra la 18a e la 25a settimana.
La diagnosi ecografica di displasia ossea presenta una bassa sensibilità (18 – 53%) ed è essenzialmente confinata alle forme letali. E’ da considerare difficile il riconoscimento dei difetti delle mani e/o dei piedi ed è impossibile diagnosticare i difetti delle dita delle mani e dei piedi. Lo studio ecografico del II trimestre si completa con la valutazione della sede di inserzione placentare, della quantità del liquido amniotico e delle flussimetrie uterine e fetali. Secondo la SIEOG non è obiettivo dell’ecografia del II trimestre lo screening delle anomalie cromosomiche mediante la ricerca dei marcatori ecografici. L’individuazione di uno o più di tali marcatori pone l’indicazione ad una consulenza specialistica appropriata.
L’esame ecografico del III trimestre può consentire di individuare quelle anomalie fetali il cui riconoscimento è difficile o impossibile nel II trimestre (ad esempio: agenesia renale monolaterale, acondroplasia, teratoma sacrococcigeo, agenesia del corpo calloso, etc.), ovvero le patologie evolutive che possono comparire in qualsiasi momento della gravidanza (idrocefalia, tumori, ernia diaframmatica, gastroschisi, patologie cardiache, patologie ostruttive renali, etc.).
Quando è arrivata in Italia, qualche anno fa, giornali e televisione hanno parlato dell’ecografia tridimensionale quasi come di una nuova moda per le future mamme: la possibilità di osservare il bambino nel pancione con una chiarezza paragonabile a quella di una fotografia. Ma l’ecografia tridimensionale non è solo uno strumento per produrre immagini spettacolari, che suscitano stupore e forti emozioni nella coppia e nei parenti. Infatti, mentre l’ecografia tradizionale fornisce immagini di semplici sezioni, quella tridimensionale consente di visualizzare i volumi, cioè permette di indagare in modo molto più accurato gli organi del feto, consentendo di individuare eventuali malformazioni del cervello, del cuore, della colonna vertebrale, degli arti inferiori e superiori, nonché di valutare con precisione le labbra, le arcate dentarie e il palato. La tecnica, comunque, richiede un training lungo in quanto è necessaria dedizione totale e costante per ottenere dei risultati soddisfacenti. L’ecografia è un momento indimenticabile di ogni gravidanza. Grazie all’ecografia tridimensionale l’immagine del feto non è più piatta, come in una fotografia, ma con volume e contorni ben definiti: tanto dettagliata da far vedere se il bambino sbadiglia o fa le smorfie. La tridimensionale è un’evoluzione dell’ecografia tradizionale. Entrambe, per ricavare immagini, utilizzano gli ultrasuoni, onde sonore ad alta intensità (non percepite dal nostro orecchio) che rimbalzano sulle superfici e permettono di visualizzare il bambino su un piccolo schermo. Mentre, però, quella tradizionale è piatta, l’ecografia tridimensionale ha il vantaggio di essere volumetrica: possiede, cioè, profondità e spessore. Le immagini, inoltre, possono essere elaborate al computer ed essere osservate da più angolazioni. Questo consente di ottenere un numero maggiore di informazioni e ciò consente allo specialista di fare una diagnosi più precisa e di individuare il modo migliore per curare l’eventuale problema. L’ecografia tridimensionale può essere utilizzata in diverse modalità, ognuna utile in un differente campo diagnostico. Vediamole nel dettaglio.
Modalità volumetrica :
fornisce l’immagine tridimensionale del viso, delle mani o dei piedini e serve in particolare a escludere anomali del volto e degli arti. In ultima analisi fornisce una vera foto e, proprio come accade per la fotografia, è necessario che la posizione del feto sia favorevole, che non vi siano davanti ostacoli (mani, cordone, placenta) ma una buona falda di liquido amniotico e, soprattutto, che il bambino stia fermo. In una buona parte dei casi si possono ottenere immagini del viso con sembianze “reali” del proprio bambino: un’emozione molto forte. Questa modalità, comunque, può essere di notevole aiuto diagnostico per lo specialista. Permette di escludere alcune anomalie del viso (ad es. il labbro leporino) o di altri distretti corporei e contribuisce a migliorare l’impiego dell’ecografia per lo screening delle malattie cromosomiche e genetiche. Permette di vedere la superficie esterna del corpo del feto. Le immagini spettacolari di bambini che sbadigliano o si succhiano un dito nella pancia della mamma sono ottenute in questo modo. Dal punto di vista medico, è utile per diagnosticare eventuali alterazioni della morfologia del viso.
Modalità multiplanare:
molto utile per la formulazione di una diagnosi, perché permette di studiare in dettaglio un organo e le sue sezioni dai diversi punti di vista. Partendo dal volume acquisito con la sonda tridimensionale consente di studiare qualsiasi piano di sezione indipendentemente dalla posizione del feto. E’ così possibile ottenere più facilmente piani longitudinali e trasversali ma, soprattutto, sezioni coronali che l’ecografia tradizionale spesso non è in grado di conseguire . Una volta ottenuto il volume, con comandi molto semplici, si possono visualizzare i vari piani e studiare nel dettaglio i particolari utili ai fini di una diagnosi. In ultima analisi si tratta di una vera e propria TAC (Tomografia Assiale Computerizzata) ottenuta con gli ultrasuoni e non con i raggi X. Consente di visualizzare qualunque sezione del corpo del bambino e di esaminare con grande precisione organi come il cervello, il cuore e l’apparato digerente.
Modalità trasparente:
l’immagine che si ottiene, simile a una radiografia, permette di vedere la struttura e la posizione degli organi interni, dello scheletro e dell’albero vascolare di tutto il corpo. Permette di vedere ed esaminare gli organi e lo scheletro del feto in tre dimensioni come se i suoi tessuti esterni fossero trasparenti. L’ecografia 4D (ovvero il tridimensionale nella quarta dimensione, il tempo) è un ulteriore evoluzione dell’ecografia tridimensionale. Alle capacità diagnostiche e di raccolta ed elaborazione dei dati offerte dalla tridimensionale, la 4D aggiunge la capacità di leggere e registrare immagini in movimento, come in un filmino. Rende possibile studiare organi pulsanti come il cuore, ma anche vedere il feto nel pancione che, per esempio, muove la manina o tira un calcetto. Per molte mamme l’esame ecografico è la realizzazione del sogno di vedere il musetto del proprio bimbo, magari proprio mentre sbadiglia o fa le smorfie (naturalmente dopo essersi assicurata con un’ecografia morfologica che sta bene e cresce regolarmente). Il momento in cui la mamma e il papà riconoscono il proprio bimbo ha un valore psicologico importante. I genitori cominciano a pensare a lui come a un individuo e a notare le somiglianze e differenze. Questa sorta di ecografia di “presentazione” ottiene risultati stupefacenti dalla 25esima settimana di gestazione, quando il bambino comincia ad essere “bello” da vedere. Prima di tale data, infatti, il piccolino è ancora molto magro, ha la fontanella aperta e gli occhi distanti fra loro: se la mamma lo vedesse così potrebbe spaventarsi e non riconoscere in lui l’immagine che si è costruita nella mente.

La diagnosi prenatale delle anomalie cromosomiche è possibile studiando il corredo cromosomico fetale attraverso il prelievo di liquido amniotico (amniocentesi), di sangue fetale (cordocentesi) o tessuto coriale (biopsia del corion). Tali metodiche invasive non sono esenti da rischi abortivi, per cui non possono essere estese a tutta la popolazione e dovrebbero essere prerogativa delle pazienti a rischio. Quali sono le pazienti a rischio di anomalia cromosomica fetale secondo il SSN?
- le gravide di età superiore o uguale a 35 anni
- le coppie portatrici di anomalie cromosomiche (traslocazioni bilanciate, mosaicismi etc.)
- le gravide che hanno già avuto un bambino nato con un’anomalia cromosomica
- le gravide che hanno avuto un figlio malformato, deceduto e non esaminato citogeneticamente
- le gravide portatrici di un feto malformato
- le gravide con anomalie dei test di screening (duo-test, tri-test, spessore della translucenza nucale etc.) che configurino un rischio di anomalia cromosomica uguale o superiore a 1:300
Pertanto, lo scopo dei test di screening è quello di individuare le gestanti a rischio di anomalia cromosomica fetale nella popolazione considerata non a rischio (età materna inferiore a 35 anni, assenza di tare ereditarie etc.).
I test di screening ecografici consistono nella ricerca di particolari segni che, secondo quanto riportato dalla Letteratura mondiale, possono essere associati ad anomalie cromosomiche. Lo screening ecografico del rischio di cromosomopatia può essere effettuato verso la fine del primo trimestre di gravidanza, mediante la valutazione della translucenza nucale, oppure tra la 17a e la 20a settimana di gestazione, mediante la valutazione di altri segni ecografici. Misurando lo spessore della “Translucenza Nucale” è possibile modificare il rischio di cromosomopatia fetale che ogni gestante presenta in relazione alla propria età. Secondo la Letteratura più recente, il riscontro ecografico di un ispessimento della Translucenza Nucale determina un aumento del rischio di cromosomopatia, di cardiopatia congenita, di sindromi genetiche e di numerose altre patologie. Bisogna però considerare che l’evento statistico più probabile è sempre quello che il feto sia normale.
Nel secondo trimestre di gravidanza, oltre allo spessore della plica nucale è possibile ricercare altri “soft markers” di anomalie fetali (cisti dei plessi corioidei, foci iperecogeni cardiaci, pielectasia, intestino iperecogeno, etc.). Tali markers, evidenziabili sia in feti sani che in feti malformati, possono essere indicativi di cromosomopatia, così come di altre patologie. Esempio tipico è l’intestino iperecogeno che può essere riscontrato in feti normali, in caso di insufficienza placentare, in feti affetti da anomalie cromosomiche, da fibrosi cistica o da infezioni.
E’ bene tenere presente che in presenza di intestino iperecogeno o di altri “soft markers” l’ipotesi statisticamente più probabile è sempre quella che il feto sia normale. L’esame ecografico del I e del II trimestre di gestazione può essere integrato o può a sua volta integrare lo screening biochimico di cromosomopatia (duo-test e tri-test). E’ bene sapere che un esame ecografico normale in presenza di uno screening biochimico anomalo non esclude la necessità di eseguire l’amniocentesi.
Lo scopo del test di screening del rischio di cromosomopatia è individuare le pazienti a rischio nell’ambito di una popolazione a basso rischio e non di escludere la necessità di eseguire l’esame del cariotipo nelle pazienti che sono già a rischio per età o per altri fattori.
Che cos’è la Translucenza Nucale?
La translucenza nucale è un’area fluida nella regione della nuca del feto, evidenziabile ecograficamente come uno spazio anecogeno posto tra la cute ed i tessuti molli che rivestono la colonna cervicale. La misurazione della translucenza nucale si effettua tra la 11a e la 14a settimana di gestazione, nella stessa sezione sagittale utilizzata per la determinazione della lunghezza vertice sacro (CRL) che deve essere compresa tra 45 ed 84 mm. Si ritiene che lo spessore della translucenza nucale superiore o uguale a 2,5 mm aumenti il rischio di anomalia cromosomica. Una cromosomopatia è presente in circa il 35% dei feti con translucenza nucale aumentata. Maggiore lo spessore della translucenza nucale, maggiore il rischio che il feto sia affetto da un’anomalia cromosomica. Si ritiene che lo studio della translucenza nucale sia il metodo ecografico più accurato per valutare il rischio di cromosomopatia fetale. I difetti cromosomici più frequentemente associati ad aumento di spessore della translucenza nucale sono la trisomia 18, la trisomia 21, la trisomia 13, la sindrome di Turner, le aneuploidie dei cromosomi sessuali e le poliploidie. Un aumento di spessore della translucenza nucale è stato riscontrato anche in caso di cardiopatie congenite, sindromi genetiche e numerose altre patologie.
Che cosa sono i Marcatori Ecografici del II Trimestre?
L’esame del II trimestre consente di studiare l’anatomia fetale e di valutare il rischio di anomalie cromosomiche evidenziando gravi malformazioni fetali e/o i cosiddetti “soft markers” (plica nucale aumentata, cisti dei plessi corioidei, pelvi renali dilatate, iperecogenicità intestinale, foci iperecogeni cardiaci etc.). I “soft markers”, evidenziabili sia in feti sani che in feti malformati, possono essere indicativi di cromosomopatia così come di altre patologie. Esempio tipico è l’intestino iperecogeno che può essere riscontrato in feti normali, in caso di insufficienza placentare, in feti affetti da anomalie cromosomiche, da fibrosi cistica o da infezioni. L’individuazione di uno o più di tali marcatori può essere indicazione ad un approfondimento diagnostico. Tuttavia, si ribadisce che non è obiettivo dell’ecografia del II trimestre lo screening delle anomalie cromosomiche.
L’insufficienza placentare è una condizione ad etiologia multifattoriale che può essere responsabile di complicazioni materne (ipertensione, proteinuria, edemi etc.) e fetali (restrizione della crescita intrauterina associata o meno a distress fetale). L’insufficienza placentare può manifestarsi in circa la metà delle gestanti che presentano alterazioni flussimetriche delle arterie uterine. Si considera a rischio di futura gestosi la paziente che presenta un elevato indice di resistenza delle arterie uterine e/o incisura protodiastolica sull’onda flussimetrica dell’arteria uterina placentare. L’incisura protodiastolica è espressione della ridotta elasticità del vaso che può accompagnarsi ad aumento delle resistenze.
Dopo la 26a settimana di gestazione lo studio delle arterie uterine ha scarso valore predittivo. Il riconoscimento del rischio di insufficienza placentare non evita lo sviluppo della patologia, ma consente di individuare quelle gestanti che necessitano di un monitoraggio più attento del benessere materno e fetale.
Anche se non è stata ancora chiaramente dimostrata l’utilità dell’esame flussimetrico delle arterie uterine in tutte le gravide, è preferibile eseguire tale studio in tutte le gestanti e non solo in quelle considerate a rischio (donne affette da ipertensione essenziale, ipercolesterolemia familiare, diabete, malattie autoimmuni, pregressa storia di mortalità perinatale e di insufficienza placentare). Nelle gestanti a rischio esiste un maggiore probabilità di sviluppare l’insufficienza placentare, anche in presenza di regolare flussimetria delle arterie uterine.
Il riscontro di una regolare flussimetria delle arterie uterine perciò indica una condizione di basso rischio per insufficienza placentare ma non esclude la possibilità che essa possa comunque verificarsi.
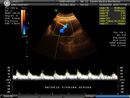
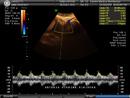
l vasi fetali più frequentemente studiati sono l’arteria ombelicale e l’arteria cerebrale media.
Le alterazioni delle resistenze ombelicali rappresentano un importante dato flussimetrico obiettivo che è possibile rilevare in caso di danno placentare. La flussimetria dell’arteria cerebrale media valuta le resistenze del vasi intracranici.
In condizioni di normalità, cioè di benessere fetale, il circolo dell’arteria ombelicale presenta basse resistenze (grande quantità di flusso) mentre il circolo della cerebrale media presenta alte resistenze (piccola quantità di flusso).
Il rapporto tra le resistenze al flusso di questi due vasi, rapporto cerebro-placentare, rappresenta un indicatore del benessere ossigenativo fetale. L’esame flussimetrico è raccomandato nelle gravidanze a rischio, caratterizzale da ritardo di crescita intrauterino, oligoidramnios, ipertensione materna, etc. In questi casi, oltre all’arteria ombelicale ed all’arteria cerebrale media, l’esame può essere esteso anche ad altri distretti fetali (arteriosi, venosi e cardiaci), nel tentativo di individuare l’insorgere di sofferenza fetale.
Si precisa che lo studio flussimetrico dei vasi fetali particolari non viene eseguito di routine ed Il suo valore nell’individuazione di situazioni di rischio è tuttora oggetto di studio.
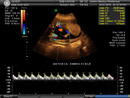
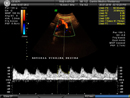
L’ecocardiografia fetale consiste nello studio morfologico e funzionale del cuore fetale. Si esegue dopo la 20a settimana di gestazione. In casi selezionati può essere utile una verifica nel III trimestre. Lo studio morfologico permette di valutare il situs cardiaco, le dimensioni del cuore, l’indice cardiotoracico, l’asse cardiaco, la scansione 4-camere, le connessioni atrio-ventricolari, ventricolo-arteriose e veno-atriali (polmonari e sistemiche). Lo studio funzionale consente di osservare l’attività delle valvole atrioventricolari (mitrale e tricuspide) e semilunari (aorta e polmonare), mediante color-doppler e doppler pulsato. Inoltre, si valuta la frequenza cardiaca fetale e le eventuali aritmie. L’ecocardiografia fetale permette di riconoscere circa l’80% delle cardiopatie congenite. Al valore finale dell’accuratezza diagnostica contribuiscono in maniera determinante alcune variabili:
- l’aumentato spessore del pannicolo adiposo materno può rendere difficile o impossibile il riconoscimento di un difetto cardiaco
- il potere di risoluzione delle apparecchiature ecografiche
- la fisiologica situazione cardiocircolatoria del feto
- l’evolutività di alcune cardiopatie congenite che possono manifestarsi in qualsiasi momento della vita.
Alcune malformazioni cardiache non possono essere diagnosticate con l’ecocardiografia fetale. Tra queste quelle anomalie in cui vi è persistenza della circolazione fetale (dotto arterioso pervio, difetto interatriale), i difetti interventricolari di piccole dimensioni, la patologia del ritorno venoso polmonare, la coartazione aortica e le cardiopatie evolutive (stenosi valvolari, cardiomiopatie, etc.). L’ecocardiografia fetale ha indicazioni materne e fetali. Le indicazioni materne sono:
- la familiarità
- le alterazioni metaboliche (diabete, fenilchetonuria, etc.)
- l’assunzione di sostanze teratogene
- le infezioni (rosolia, parotite, parvovirus, citomegalovirus, coxsackie virus, etc.)
- le malattie materne (malattie autoimmuni etc.)
Le indicazioni fetali sono:
- la presenza di una malformazione cardiaca o extracardiaca
- la translucenza nucale aumentata
- il ritardo di crescita intrauterino, soprattutto se simmetrico
- il polidramnios e l’oligoidramnios
- le aritmie fetali
La diagnosi prenatale di cardiopatia congenita può consentire:
- di sospettare una cromosomopatia
- di sospettare una malformazione extracardiaca
- di pianificare la nascita in una struttura idonea ad accogliere il neonato cardiopatico
- di diminuire il tasso di mortalità per cardiopatia congenita.